Direkt vor meinem Urlaub hatte ich Gelegenheit, Adrian Bird zu den neuen Daten zu befragen, die er in seiner letzten Arbeit vorstellt. Die Arbeit wurde im Fachmagazin Molecular Cellveröffentlicht. Die meisten Leser dieses Blogs werden wissen, dass Professor Bird Anfang der 90er das MeCP2-Protein entdeckt hat. Er arbeitete derzeit am Forschungsinstitut für Molekularpathologie in Wien. Fast ein Jahrzeht später richtete Huda Zoghbis Entdeckung, dass Mutationen an MeCP2 das Rett-Syndrom auslösen, Professor Birds Interesse auf das Gebiet der Neurowissenschaften. Zum ersten Mal beschäftigte er sich mit Forschungsgegenständen, die für menschliche Erkrankungen bedeutend sind. 2007 veröffentlichte er die bahnbrechenden Experimente zur Umkehrung der Symptome.
Wir erwarten also neuartige und bedeutende Einblicke aus dem Labor von Bird. Diese neue Arbeit definiert unsere Sichtweise des Wirkungsbereichs und der Funktion von MeCP2 neu. Mit den Worten des Co-Autors Peter Skene ist es vielleicht „der Wächter des neuronalen Genoms.“
VOLLSTÄNDIGE PRESSEMITTEILUNG (engl.)
Dr. Adrian Bird 
MeCP2 wird global
MC: Ich fand die Daten in Ihrer letzten Arbeit sehr bemerkenswert, was die hohen Stufen und die weite Verbreitung von MeCP2 betrifft.
AB: Ja, MeCP2 ist außerordentlich abundant. Die meisten Transkriptionsfaktoren, also Proteine, die Gene ein- und ausschalten, sind zu etwa 10.000 bis zu maximal 100.000 Molekülen in einer Zelle enthalten. Bei MeCP2 sehen wir 100 bis 1.000 Mal mehr als das. Es gibt im Zellkern tatsächlich fast genausoviel MeCP2 wie Nukleosome. Nukleosome sind strukturelle Basiseinheiten von Chromatin, aus dem wiederum die Chromosomen gebildet werden. Es ist in einer Zelle also genug MeCP2 vorhanden, um möglicherweise das gesamte Genom abzudecken.
MC: Mich hat fasziniert, dass MeCP2 ebenso an Nicht-Gene bindet wie an Gene.
AB: Was MeCP2 angeht, so scheint es sich an Gene zu binden, oder eben nicht. Es bindet einfach überall, wo Methylgruppen sind.
MC: Dann folgt MeCP2 der Methylation über das ganze Genom.
AB: So ist es, und dieses Verfolgen der DNA-Methylation könnte die Umkehrbarkeit schwerer Rett-Symptome erklären, die wir bei speziellen Mausmodellen sehen konnten. Der wichtige Entwicklungsschritt ist jetzt, das korrekte Muster der Methylation zu ermitteln und das Muster, das normalerweise bei Rett-Patienten zu passieren scheint. Wenn dieses Muster einmal geklärt ist und MeCP2 wieder eingebracht wird, wie wir es bei den Umkehrungsexperimenten gemacht haben, geht das Protein einfach an den Ort, den die Methylation vorgibt, und erfüllt dort seine Funktion.
Das Genom – Es geht nicht nur um Gene
MC: Vielleicht ist dies ein guter Zeitpunkt, um unsere Leser daran zu erinnern, dass nur 5% des Genoms tatsächlich aus Genen besteht. Der Rest ist das, was häufig „Ramsch-DNA“ genannt wird, weil die Forschung darin bisher keine Funktion entdecken konnte. Ich fand den Begriff „Ramsch-DNA“ immer etwas arrogant und bezweifle, dass 95% unseres Genoms Ramsch ist. Aktuelle Arbeiten legen tatsächlich die Überlegung nahe, dass der Ramsch in Wirklichkeit regulierende Funktionen hat.
AB: Da liegen Sie absolut richtig, wir sollten keine Bestandteile des Genoms als Ramsch betrachten. Viel von dieser so genannten „Ramsch-DNA“ wurde über Millionen von Jahren konserviert, und allein diese Tatsache lässt vermuten, dass der „Ramsch“ einen guten Grund hat, um da zu sein.
MC: In den letzten Jahren wurde die Annahme, dass MeCP2 an methylierte DNA bindet, ein wenig hinterfragt. Diese Arbeit bestätigt das wieder und arbeitet es weiter aus. Wohin führt uns das?
AB: Ich denke, dass diese Bestätigung zusammen mit einer Abundanz von MeCP2, die ausreicht, um alle Methylgruppen im Genom abzudecken, uns etwas über die Funktionen von MeCP2 sagen kann.
MeCP2 neu definiert
MC: Wir können also weiterhin annehmen, dass Rett-Symptome auf eine fehlerhafte Unterdrückung von nachgeschalteten Genen durch MeCP2 zurückzuführen sind?
AB: Das bleibt eine Behauptung, die noch bewiesen werden muss. Wir warten immer noch auf den Beweis, dass einzelne Gene Rett verursachen, wenn die Expression wegen MeCP2 nicht richtig funktioniert. Es ist noch ein weiter Weg, die Verbindung zwischen der Nicht-Unterdrückung durch MeCP2 und den Rett-Symptomen herauszufinden.
MC: Was ist dann mit den Arbeiten, die einzelne Gene als Ziel von MeCP2 bezeichnen?
AB: Es gibt tatsächlich eine Reihe Arbeiten, einige davon aus unserem Labor, die sagen, dass spezielle Gene verändert erscheinen, wenn MeCP2 fehlt. Diese Entdeckung findet Unterstützung in Experimenten, die zeigen, dass MeCP2 an diese Gene bindet. Die Daten scheinen also einen Sinn zu haben. Wenn man sich aber klarmacht, dass MeCP2 absolut überall bindet, wird die Idee von Zielgenen etwas weniger interessant und vielleicht sogar weniger bedeutsam.
MC: Wenn MeCP2 kein Transkriptionsfaktor ist, wie man bisher angenommen hat, wie würden Sie es nennen?
AB: Vielleicht eine Alternative zum Linker-Histon 1. Vor Ewigkeiten haben wir gezeigt, dass MeCP2 und das Linker-Histon HI darum wetteifern, Chromatin auf methylierter DNA anzubringen. In dieser Arbeit zeigen wir nun, dass die Mengen an HI, die im Gehirn normalerweise nur geringfügig vorhanden sind, dramatisch ansteigen, wenn MeCP2 fehlt. So gesehen ähnelt MeCP2 deutlich einem Histon.
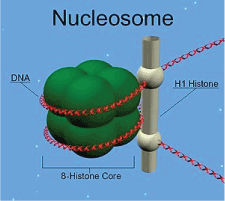
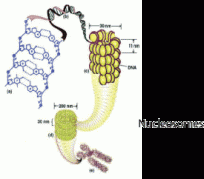
MC: Gewähren wir unseren Lesern kurz einen Einblick in die Hintergründe: Histone sind Proteine, die an eine Spule erinnnern, um die sich die DNA windet. Diese Windungen machen es möglich, dass die 1,8 Meter lange DNA in jede unserer Zellen passt. Es gibt zwei Klassen von Histonen: Kern-Histone und Linker-Histone. Kern-Histone bilden die Spule, um die sich die DNA windet, etwa wie Perlen auf einer Schnur. Linker-Histone sind die DNA, die die Perlen voneinander trennt. HI ist eins von zwei Linker-Histonen. Bildlich gesprochen ist ein Linker-Histon die Schnur zwischen den Perlen einer Halskette.
MC: Eine weitere Beobachtung in Ihrer Arbeit ist, dass MeCP2 möglicherweise im gesamten Hirn ein- und dieselbe Funktion erfüllt. Können Sie das weiter ausführen?
AB: Manche Forscher glauben, dass MeCP2 verschiedene Dinge in verschiedenen Nervenzellen tut. Unsere Daten lassen vermuten, dass das Muster der MeCP2-Bindung immer ähnlich ist, ohne direkten Zusamenhang mit der Hirnregion. Dieser Schwerpunkt ließ die Idee aufkeimen, dass es bei Abwesenheit von MeCP2 ein generisches Problem mit Nervenzellen gibt und dass die örtlichen Auswirkungen etwas damit zu tun haben, was diese Nervenzellen im Hirn tun, also nicht so sehr, dass MeCP2 verschiedene Dinge an verschiedenen Orten tut. Mit anderen Worten: MeCP2 macht überall das Gleiche, aber die Konsequenzen variieren.
Wir haben im Moment eine große Menge Daten aus verschiedenen Laboren, die uns in vielfältige Richtungen weisen. Ich würde gern einen Weg durch all diese Komplexität hindurch finden und sagen können: Das ist es, was in all diesen Nervenzellen falsch läuft. Was mich antreibt, ist die Möglichkeit, dass es am Ende gar nicht so kompliziert sein wird.
MC: Das wäre ein schönes und sehr willkommenes Szenario. Vielen Dank, dass Sie mit uns Ihre neueste Arbeit besprochen haben, Professor Bird. Ich freue mich schon, unseren Lesern bald noch mehr Neues über Ihre Arbeit berichten zu können.